11月5日,CDE第2次向行业征求关于展开化学药品注射剂仿制药分歧性评价任务相关技术要求的意见,意味着化学药注射剂分歧性评价的正式政策文件无望不久后出台。不过在政策落地之前,曾经有局部企业在注射剂分歧性评价赛道上率先动身,并在4+7带量推销以及扩围中占得先机。
与此同时,还有更多企业依照旧化学分类或许新化学注册分类申报的注射剂种类也陆续获批,给注射剂分歧性评价和后续铺开的带量推销添加新的竞争要素和变数。昔日,又有多个重磅注射剂种类获批。
1、地佐辛注射液——南京优科
11月20日,南京优科制药依照老6类申报的的「地佐辛注射液」上市请求操持形态变卦为“审批终了-待制证”。获批之后,南京优科制药将成为继扬子江之后国际第2家该种类获批的企业。
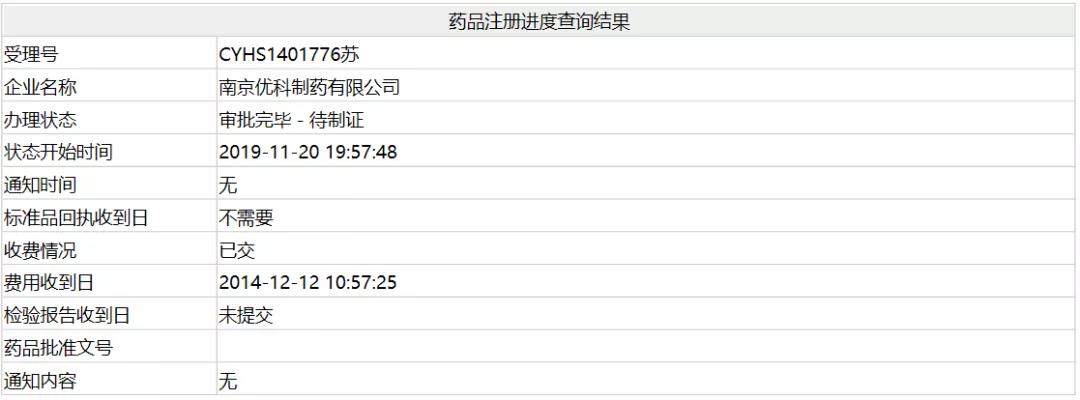
地佐辛是一种强效阿片类镇痛药,它能缓解术后疼痛,其镇痛强度、起效工夫和作用继续工夫与吗啡相当。研讨显示,地佐辛止痛效应与剂量相关,临床运用一次最大剂量为30~50mg,超越此剂量镇痛作用添加不分明。地佐辛可独自用于中小手术后镇痛,或在中大手术后与其他镇痛药结合使用,以加强镇痛作用。
此前,地佐辛注射液为扬子江独家种类。数据显示,扬子江地佐辛注射液自2008年获批以来,增速迅猛,以后中标价中值为177.39元/支和92.74,2008年公立医院销售额打破50亿元。
2. 盐酸右美托咪定注射液——成都倍特药业
11月20日,成都倍特药业依照老6类申报的手术镇静剂类药物「盐酸右美托咪定注射液」上市请求操持形态变卦为“审批终了-待制证”。
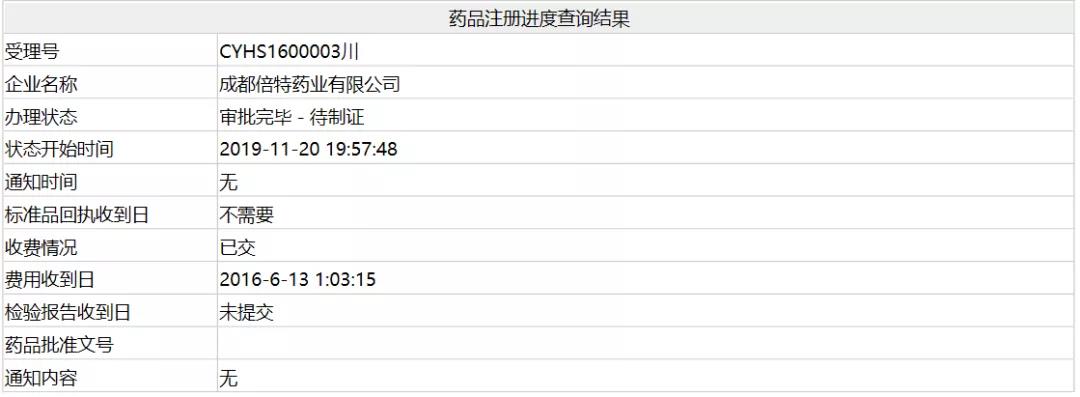
右美托咪定为α2-肾上腺素能受体冲动剂,具有中枢性抗交感和抗焦虑作用,能发生近似自然睡眠的镇静作用,临床上次要用于气管内插管行呼吸机医治患者的镇静,围术期麻醉兼并用药及有创反省或医治时的镇静。
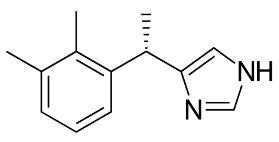
右美托咪定构造式
盐酸右美托咪定注射液原研药由美国的Hospira公司开发,商品名:Precedex。1999/12/17获FDA同意上市,2009年获批进入中国市场。2018年Precedex销售额为2.13亿美元。
该种类目前仅扬子江一家经过分歧性评价,所以在4+7集采和联盟集采时中标完全“无压力”,不用杀价太多便一举拿下50%的采集量。这令扬子江自3月11个试点陆续执行“4+7带量推销“之后,在短短3个月的工夫内,从拥有极小的市场份额跃升为市场份额最大的厂家,其他企业只能拼尽全力抢夺剩余的市场份额。
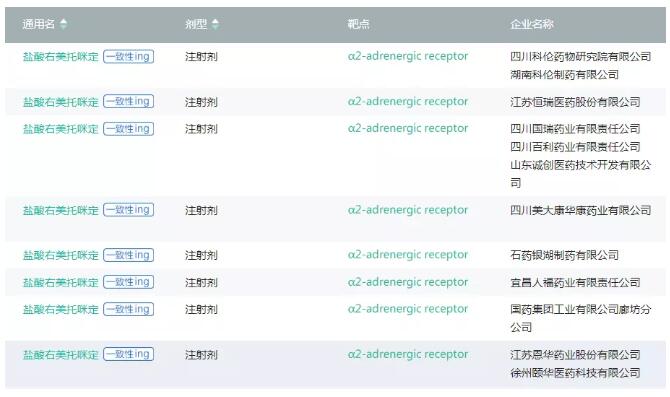
依据医药魔方数据库PharmaGo显示,目前共有8家企业的盐酸右美托咪定注射液上市,辨别为四川国瑞药业、宜昌人福药业、山东希尔康泰药业、扬子江药业、恒瑞医药、恩华药业、科伦制药和辰欣药业。恒瑞在盐酸右美托咪定注射液上也有较好的销售根底。另外还有8家企业正在停止分歧性评价,很能够在明年的带量推销中成为竞争玩家。
3. 磺达肝癸钠注射液——信泰制药
11月20日,信泰制药依照依照老6类申报的磺达肝癸钠注射液上市请求操持形态变卦为“审批终了-待制证”。获批之后,信泰制药是第2家消费磺达肝癸钠注射液的国际企业。
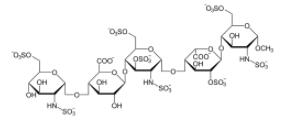
磺达肝癸钠能选择性抑制抗凝血酶 III介导的因子 Xa,显现抗凝血效应,适用于预防髋骨骨折手术,髋关节置换手术,膝关节置换手术或腹部手术的患者的深静脉血栓构成,以及结合华法林医治DVT或急性肺栓塞。
磺达肝癸钠原研厂家为默克/GSK/赛诺菲,2008年在中国获批上市。作为一种人工分解的五糖相似化合物,磺达肝癸的分解工艺十分困难而昂贵,因而玩家稀少。恒瑞去年5月披露取得该种类美国ANDA文号时,研发投入为7900万美元。IMS数据库显示,2017年磺达肝癸钠注射液在中国市场销售额约为294万美元,美国市场销售额约为6953万美元,全球市场销售额约为1.9亿美元。
信泰制药是科创板新贵博瑞医药的子公司,而博瑞医药正是以高端仿制药开发在业内知名。博瑞医药此前主营高端原料药欧美出口业务,此次获批的磺达肝癸钠注射液也是其在中国上市的第一个注射剂种类。
恒瑞的磺达肝癸钠注射液以优先审评通道于2008/5/23获批,成为国际首仿,国际中标价为135.00元/支。医药魔方数据库PharmaGo显示,恒瑞已于2018/9/30向CDE提交了分歧性评价的补充请求,目前形态为“在审评”,另外,恒瑞该种类也已取得FDA同意文号。国际依照新4类申报的企业有南京健友生化制药和兆科药业2家。
4. 注射用米卡芬净钠——上海天伟生物制药
11月20日,上海天伟依照老6类申报的抗真菌类药物「注射用米卡芬净钠」的上市请求操持形态变卦为“审批终了-待制证”。获批之后,上海天伟生物制药是继海正、豪森之后第3家拿到该种类上市资历的国际企业。
米卡芬净是安斯泰来经过发酵半分解技术开发的脂肽类化合物,也是继卡泊芬净之后获批上市的第二个棘白菌素类抗真菌药物,由真菌Cokeophoma empetri的发酵产物研制而成。
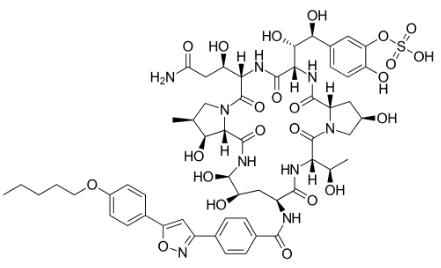
米卡芬净构造式
注射用米卡芬净钠最早于2002年12月在日本上市, 2005年3月经过美国FDA认证,目前仅被同意用于医治食道念珠菌感染、骨髓移植及ADS患者中性粒细胞增加症的预防医治。2006年4月即在中国获批,用于医治由曲霉菌和念珠菌惹起的真菌血症、呼吸道真菌病、胃肠道真菌病。
发酵半分解药物,需求先经过发酵技术取得主环粗品,再经过火离纯化取得两头产物,再以两头产物为起始物料,采用分解技术完成侧链拼接,最终取得目的成分。由于“发酵半分解”的产品需求经过发酵,别离纯化,分解等多个技术环节,技术道路和进程参数控制十分复杂。
海正药业是国际发酵半分解技术的抢先企业之一,在2018/4/12获批拿下注射用米卡芬净钠首仿;豪森则紧随其后在2018/5/23获批上市。另外,目前该种类还有杭州中美华东、信泰制药、奥赛康、四川制药制剂共4家企业申报上市,海正药业的注射用米卡芬净钠也在分歧性评价请求当中。
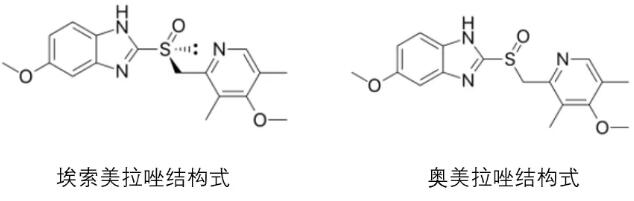
5. 注射用埃索美拉唑钠——正大丰海
11月20日,正大丰海依照老6类申报的注射用埃索美拉唑钠的上市请求操持形态变卦为“审批终了-待制证”。
埃索美拉唑是奥美拉唑的S-异构体,可以经过特异性的靶向作用机制增加胃酸分泌,为壁细胞中质子泵的特异性抑制剂。临床顺应症次要为当口服疗法不适用时,胃食管反流病的替代疗法。该药原研厂家为阿斯利康,商品名为Nexium。2018年Nexium销售额到达24亿美元。
正大天晴的艾速平(艾司奥美拉唑钠)于2016年在中国获批以来,2018年销售额已到达7.5亿元,估计2019年可打破10亿。
国际市场上,目前有18家企业消费销售注射用埃索美拉唑钠,次要市场份额被原研厂家阿斯利康和奥赛康、正大天晴占据,其中正在请求/视同请求分歧性评价的厂家有9家,包括正大天晴、奥赛康和海思科等。
xgeva
| 上一篇:曲氟尿苷复方片,DRG对商业安康险的影响 | 下一篇:抗癌药多国同步获批!造福全球病患的Orbis方案又有国家参与! |




