最佳的临床实验监查办法,是侧重于关键需求的办法,而不是对能够影响患者平安或数据完好性的一切成绩全包全揽。最好的方式,是采用基于风险的监查,或更为片面的基于风险的质量管理战略。
FDA要求临床实验申办者,“提供监查,确保充沛维护受试者的权益、福利和平安,以及提交给FDA的数据质量。”但由于行业不断以为,采用片面和资源密集的办法,是取得高质量后果的最佳办法,因而传统上,不断采取现场监查与100%源数据验证审核临床实验质量。这样的办法,不只昂贵、费时,也不能保证质量。
监管机构曾经看法到,最好的方式,是采用基于风险的监查,或更为片面的基于风险的质量管理战略。FDA在2013年引荐采用RBM;并在2016年采用经修订的ICH-GCP E6-R2指南,其中将RBM确定为一切临床实验的强迫要求。在往年发布的《行业指南:基于风险的临床研讨监查询答》中,FDA重申:“基于风险的监查,是使申办者可以在临床研讨进程中辨认确定和处理成绩的重要工具。”
近日,临床研讨组织协会发布调研报告,详细剖析了ARCO成员在临床实验中运用RBM的状况。
RBM与RBQM办法
作为质控活动的根底,RBM是一种顺应性的临床实验监查办法,可以将监查重点和活动,导向关于受试者平安与数据质量最为需求的方面。RBM的两个次要组成局部是现场和集中监查。现场监查包括源数据验证与源数据审核的组合。SDV是临床实验监查的根本现实核对进程,经过对病例报告与原始来源停止穿插核对,确认数据的精确性,确保实验可以反复。SDR与SDV不同,不触及对病例报告表的反省。SDR触及到审查源文件记载与方案合规性,相关方面必需确保关键流程与源文件记载充沛,契合药品临床实验标准要求。电子数据记载的不时开展,集中监查失掉越来越多的使用,使得文件审查、数据审查和剖析都可以近程展开,不一定需求向研讨场所差遣反省员。FDA与EMA指南文件,现已将QBD与SDV、SDR、CM视为基于风险的质量管理全体办法的一局部。
在2019年7月举行的一次FDA研讨会上,FDA药品审评与研讨中心迷信调查办公室主任David Burrow博士指出,在现行的临床实验环境中,FDA激烈鼓舞采用临床实验监查,把质量挺在前边,以质量为中心。在这种状况下,更为恰当的做法,是将RBM视为“不会发生重要过失”的基于质量的体系的一个方面。
但一些人士以为,RBM自身是目的,而不是一个全体上基于质量体系的工具。在某些状况下,行业能够只是试图在曾经制定的协议根底上,采用RBM战略。这种做法不太能够成功,还会添加不用要的本钱。为了片面施行RBQM,FDA制定了三个需求按顺序执行的必要步骤。首先,合同研讨组织必需在实验前和实验时期展开。其次,应依据风险评价时期确定的要素,制定明白的研讨方案。最初,依据风险评价与研讨方案,量身定制RBM办法。
重要的是,向RBQM迈进,不只是美国的监管重点,也是全球的监管重点。EMA对用于改善临床实验监查的质量权衡规范,承受水平更深。2013年,EMA发布了临床实验中,基于风险的质量管理指南。尤其值得留意的是,在RBQM顺序流程方面,EMA和FDA指南高度分歧:“应在方案设计开端时,就将降低措施归入方案和其它与实验相关的文件。”
基于质量源于设计的,为临床实验监查提供了片面质量管理办法。QbD在最后的设计阶段,将质量整合到临床实验方案中,协助确保监查战略优先思索关于患者平安和数据完好性至关重要的要素。
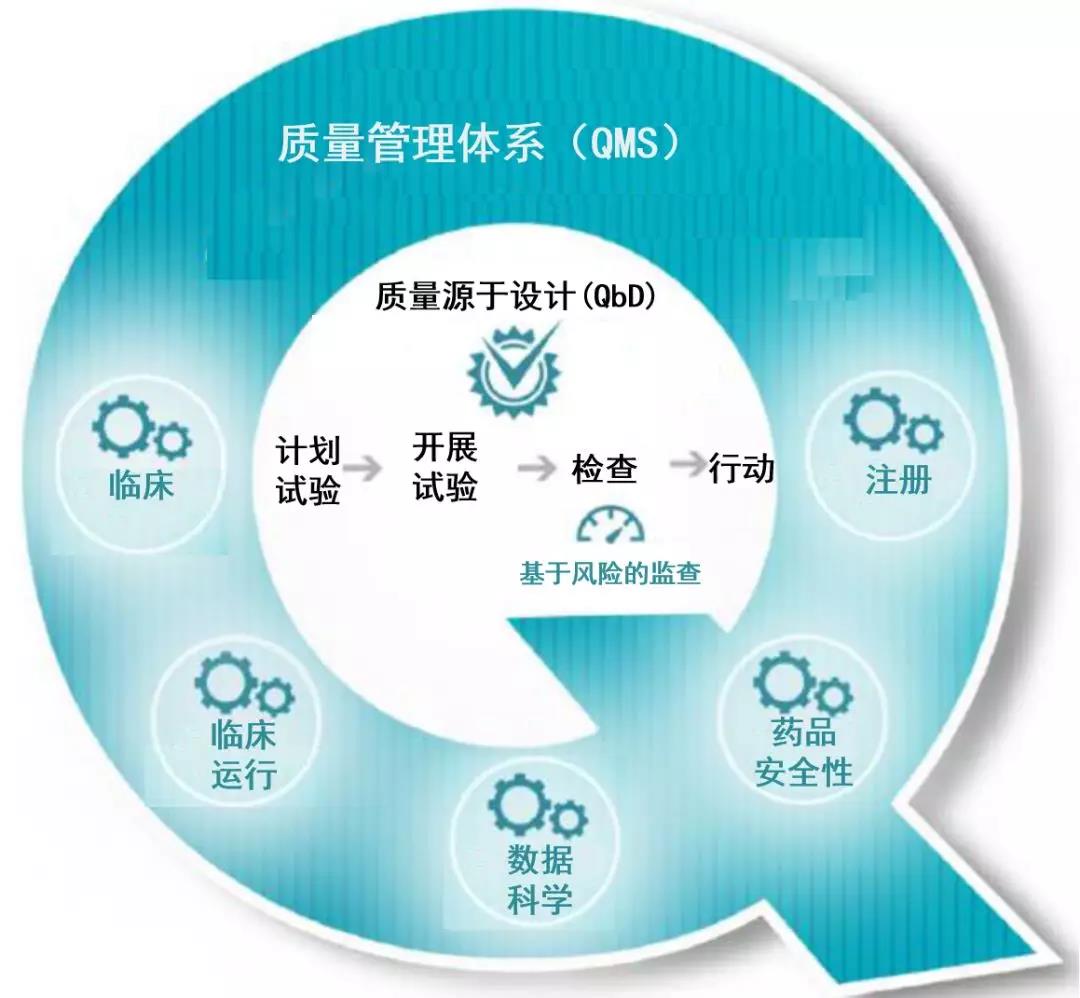
图片来源:参考材料[11]
在临床实验范畴,RBM并非新概念。银行业与航空工业运用RBM,已有很长历史。临床实验中运用RBM,也超越10年工夫。据统计,2016年,归入RBM的新临床实验占比为18%, 2017年和2018年,这一占比辨别上升至41%和61%。但由于不同的组织,对RBM的定义各有差别,因而,很难精确阐明RBM在临床实验中的盛行水平;也无法答复在基于质量的体系中,RBM办法的施行能否适当的成绩。虽然如此,少量的证据标明,在临床实验监查中,RBM所发扬的作用越来越重要。
ACRO调研后果:RBM使临床实验质量核对更无效
临床研讨组织协会的成员包括多家知名的合同研讨组织公司。近日,ARCO发布了对成员组织在临床实验中运用RBM的调研报告。

下图为这次调研的后果小结。申办方反映,采用RBM办法,放慢了质量审核流程,使临床实验质量核对愈加无效,有助于更快捷地将数据提交给FDA,可以更快地为患者提供所需的疗法。报告显示,当公司经过RBM模型核对数据时,合同研讨组织与申办方更有能够更早地检测到质量成绩,并在临床实验场所疾速整改。关于临床实验中的患者平安而言,这种监查办法最至关重要。
与100%的SDV和现场核实相比,RBM的工夫耗费和资源耗费更少,可以提供更好的质量,这似乎与直觉相反。合同研讨组织越来越多地将RBM归入临床实验监查中,不只是为了呼应监管机构的要求,还在于行业将RBM和QbD战略适当归入基于体系的途径,可以为申办方带来直接获益,改良临床实验数据的质量。随着临床实验越来越多,状况越来越复杂,预期RBM办法的重要性,将继续添加。ACRO表示,将持续与FDA协作,鼓舞整个行业更普遍地采用RBM。

图片来源:参考材料[2]
临床实验中RBM使用缺乏
RBM可以改善临床监查流程,同时降低本钱和对资源的占用。但在临床实验中,RBM办法并未失掉充沛使用。调研报告罗列了面临的多项应战。这些应战,能够限制了以知觉管理和希冀管理为中心的RBM在更大范围内的使用。一些公司错误地以为,传统监查办法风险较低,数据反省战略更平安,完好的SDV是确保数据质量的最佳办法。2017年,Hurley等宣布于Trial上的一项对132项学术主导的临床实验的调研后果发现,施行RBM面临的很多妨碍,是由于研讨者对流程的理解不充沛所致,包括对本钱收益的曲解,以及对RBM缺乏理解。
ARCO的这份调研报告显示,行业在促进RBM的运用方面,面临多项严重应战。“革新管理”是行业所面临的应战之一。由于RBM办法需求多个利益攸关方参与,包括合同研讨组织、申办方和研讨场所,假如采用RBM办法,都必需承诺保持已经旧有的临床实验监查办法。此外,这些利益攸关方,只是效果管理制无效运作所需机制的一局部。其它需求无缝结合、运转流利的组成局部,包括初始风险确定,以及更为普遍质量管理体系的组成局部,例如数据迷信和临床运转。此外,一切这些局部,都必需以发生本钱效益的方式运转。例如,虽然在临床实验中引入集中监查,可以进步患者平安性,但假如在引入CM的同时,持续坚持100% SDV的方式,实践本钱一定会添加。此外,RBM需求按顺序操作,首先需求适当的风险评价,然后制定明白的研讨方案。
另外的应战在于,行业不只需求在基于质量的体系内整合一切RBM步骤,还需求树立不同利益攸关方之间的数据保管链。假如在某些状况下,申办方担任电子数据采集,合同研讨组织担任数据管理,另一方担任集中监查,招致数据和数据源无法集中维护,各方难以拜访。由于客观上存在这些难点,使得一些公司不情愿保持传统的临床实验监查办法。
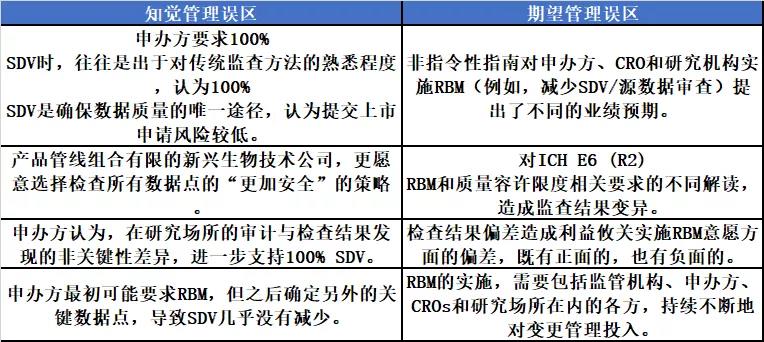
充沛推进RBM施行
虽然在过来几年中,RBM已成为临床实验中更罕见的要素,但ACRO依然以为,RBM并没有失掉充沛应用。之前的相关调研显示,多位受访者采用RBM,是为了满足监管要求,标明假如业界强调采用RBM是监管机构认可的指点方针,能够会扩展RBM的承受范围。因而,为了鼓舞更普遍地施行RBM,ACRO建议FDA授予RBM最佳理论位置。
其它潜在的推进要素,包括为研讨者提供额定培训,以更好地理解施行RBM的好处但是,关于缺乏工夫和资源来应对临床实验监查复杂性的公司和研讨者,只是增强RBM培训,并缺乏够。RBM自身属于一种风险降低机制,需求融入基于全体体系的临床实验监查办法中。合同研讨组织可以协助申办方,将“数据知识”的概念整合到基于体系的办法中,而不是仅仅专注于契合申办方战略目的的RBM的特定局部,例如增加SDV和现场监控。
具有丰厚临床实验监查经历的合同研讨组织,十分合适指点申办方完成此进程,协助将RBM的多个组件精密地调校到满足优化数据完好性和患者平安性的要求。关于某些临床实验,从外表上看,尝试从这些组件中选择几个,似乎可以派上用场,但这种零敲碎打的方式,存在本钱添加,或降低质量的风险。合同研讨组织可与申办方协作,编制RBM要素清单,并就如何将这些要素没有差异地归入基于质量的体系提出建议。应该强调,RBM能够不会立刻节省费用;但可以经过更普遍地采用RBM办法来进步效率。
ARCO的调研报告建议申办方尽早与合同研讨组织协作,树立临床实验数据保管链。这种协作,应在实验规划进程的晚期就开端,以便各方理解集中监查所需的数据的地位,以及受权可以拜访数据的人员。
最初,施行RBM,还需求行业承受在临床实验监查的变化,并创立新的角色,例如风险管理经理,以及拥有临床和数据剖析技艺的集中监查员。新、旧技术的整合也很重要。例如,经过制定战略,将CM采集的数据整合到临床实验管理零碎中,使得临床研讨助理可以方便地运用这些数据。
RBM是临床实验监查的中心。监管机构日益鼓舞,作为基于风险的质量体系一局部,将RBM投入运用。越来越多的证据标明,行业可以将RBQM视为确定临床实验时期成绩的最佳理论。其它的多个行业,早已将RBM作为降低已辨认风险的办法。但是,即使监管机构发布指南曾经有5年多工夫,但申办方关于完全承受RBM,还存在一定水平的顺从。在某种水平上,这样的顺从,是出于对革新的天性顺从;另一方面,则是由于对施行基于体系的方法的复杂性所致。虽然行业在施行RBM下面临的应战令人望而却步,但绝非不可克制。在RBQM和RBM施行方面,拥有丰厚经历合同研讨组织,具有共同优势,可以经过风险评价和监查活动与申办方协作,确保在临床实验整个生命周期中的受试者平安与数据质量。
cd30| 上一篇:Venclexta,西医药大学被《世界医学院校名录》除名? | 下一篇:奥瑞珠单抗,医学难题呼吸道合胞病毒疫苗无望商业化? |




