日前,FDA发布电子格式提交临床研讨用新药平安性报告指南草案,要求申办者在指南最终版发布24个月后,向FDA不良事情报告零碎提交IND的严重和不测可疑不良事情平安报告。做出这一规则的缘由何在?详细触及到哪些提交?

图片来源:参考材料[1]
改动现行提交方式,改良审查、跟踪效率
依照现行要求,FDA要求这些报告都以PDF格式的电子通用技术文件提交。但对这些文件的审查和跟踪效率低下,消耗少量人力。因而,FDA要求将这些重要的平安信息作为构造化数据元提交给FAERS,有助于进步 FDA 审查和跟踪临床实验时期发作的潜在平安信号的才能,并为申办方提供契合ICH E2B要求以及向其它监管机构报告的要求报告格式。对相关提交要求的转变,是FDA详细落实《联邦食品、药品和化装品法案》第745A节规则的电子提交要求任务的一局部。
FDA表示,申办方目前还可以持续经过eCTD提交相关的IND平安报告;但在要求失效之前,申办方可以自愿向FAERS提交报告。但最终版指南一旦失效,FDA将要求IND平安报告的提交契合新指南的规则,取代2019年1月公布的《依照eCTD标准提交局部人用药品请求和相关提交》行业指南的相关规则。

图片来源:参考材料[2]
根据指南规则,申办方必需经过 FDA 的电子提交网关或平安报告门户 , 向FAERS 提交相关的 IND平安报告。
经过FAERS提交IND平安报告所涉范围
新发布的指南草案,不适用于严重和不测疑似不良事情之外的IND平安报告,诸如详细阐明来自于其它研讨的后果的报告,来自于实验植物或体外检测的后果,或严重疑似不良反响发作率添加的报告。此外,FDA表示,虽然FDA鼓舞申办方以电子方式提交,非商业性IND的提交,将豁免第745A节规则的电子提交要求。
除了指南草案之外,作为指南草案的补充,FDA 还发布了独自的技术契合性指南,详细阐明应以eCTD格式提交给FDA的个案平安报告 ,以及提交给 FAERS 的 IND 平安报告应采用的格式。

图片来源:参考材料[3]
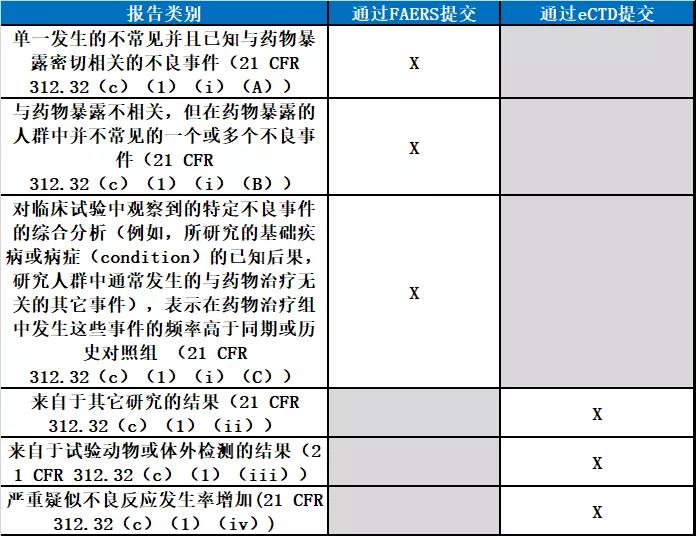
▲IND平安报告的类别与提交方式
FDA正在就这份指南草案咨询医药行业和利益攸关方的建议与意见,咨询日期截止于往年年底。
参考材料:
[1] FDA. Guidance Document. Providing Regulatory Submissions in Electronic Format: IND Safety Reports . Oct, 2019. Retrieved Nov 1, 2019 from https://www.fda.gov/media/132079/download
[2] FDA. Guidance for Industry: Providing Regulatory Submissions in Electronic Format — Certain Human Pharmaceutical Product Applications and Related Submissions Using the eCTD Specifications. Jan, 2019. Retrieved Nov 1, 2019 from https://www.fda.gov/media/120094/download
[3] FDA. Guidance for Industry. ELECTRONIC SUBMISSION OF IND SAFETY REPORTS TECHNICAL CONFORMANCE GUIDE. Oct, 2019. Retrieved Nov 1, 2019 from https://www.fda.gov/media/132078/download
[4] 21 CFR § 312.32 - IND safety reporting. Retrieved Nov 1, 2019 from https://www.law.cornell.edu/cfr/text/21/312.32
[5] Michael Mezher. FDA to require certain IND safety reports be submitted to FAERS. Oct 31, 2019. Retrieved Nov 1, 2019 from https://endpts.com/fda-to-require-certain-ind-safety-reports-be-submitted-to-faers/
| 上一篇:CCR2019:早筛、科研齐头并进 依图引领医疗AI风潮 | 下一篇:研发日报丨百济神州PD-1审评状态更新 信达生物3款新药获批临床 |




