11月13日,新浪医药得悉,国度药监局药品审评中心已完毕其PD-1“替雷利珠单抗”注册请求的技术审评任务,并已在11月13日报送国度药监局停止审批,种类技术审评建议结论为“同意消费”。
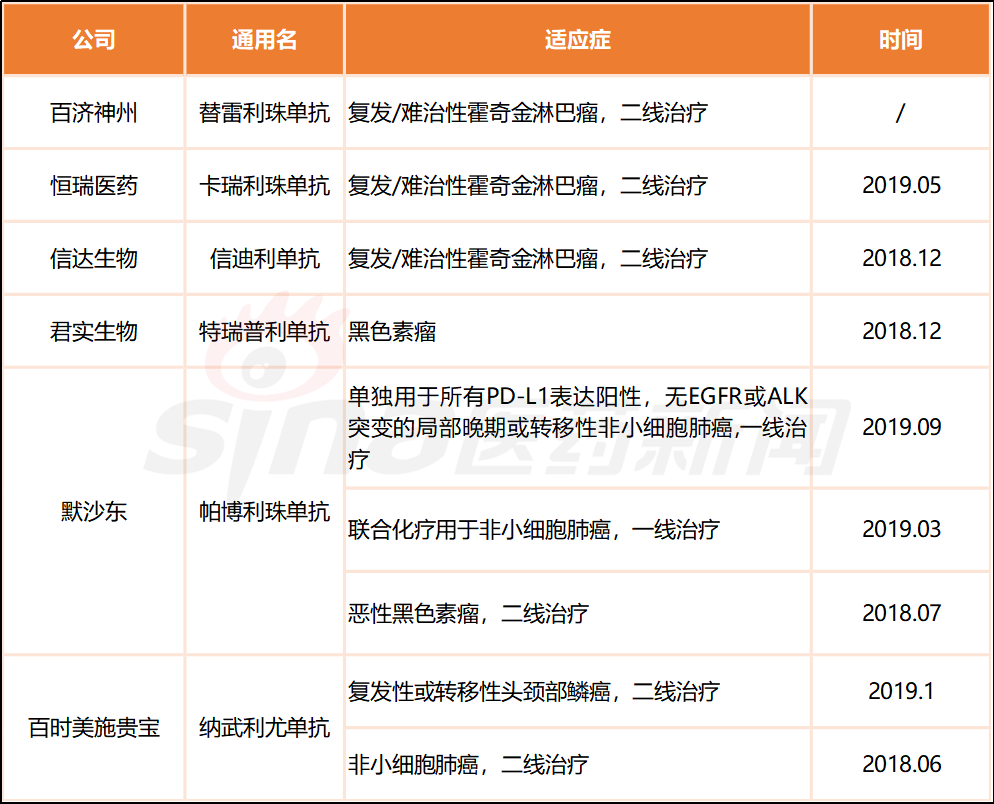
这意味着“替雷利珠单抗”获批已进入本质阶段。此前,君实生物“特瑞普利单抗”、信达生物“信迪利单抗”、恒瑞医药“卡瑞利珠单抗”先后获批上市,以及两款出口产品,即百时美施贵宝“纳武利尤单抗”、默沙东“帕博利珠单抗”已走在前列,辨别拿下多个顺应症,详见下表。
表1 中国同意上市5款PD-1抗体与百济“替雷利珠单抗”
作为第6款在国际行将获批上市的PD-1抗体,“替雷利珠单抗”虽不占据先发优势,但相较其他国产同类产品更具创新性,临床表现上更胜一筹。
数据显示,“替雷利珠单抗”在NCT3209973研讨中的客观缓解率高达85.7%,其中完全缓解率61.40%,9个月时的缓解继续率高达84%,远高于“纳武利尤单抗”和“帕博利珠单抗”的临床表现,目前有能够是全球better或best的PD-1单抗。
11月1日,百济神州高管个人承受国际媒体采访时,百济神州中国区总经理兼公司总裁吴晓滨表示,关于PD-1来说,不是马拉松而是百米赛,产品能不能成功,取决于是不是有差别化和特征。“替雷利珠单抗”免疫激活作用更强,在霍奇金淋巴瘤上,O药和K药的治愈率只要20%,“替雷利珠单抗”则高达60%。
据悉,“替雷利珠单抗”还已在国际提交了用于医治先前承受过医治的部分早期或转移性尿路上皮癌的顺应症请求,估计将于2020年取得上市同意。
此外,百济神州初级副总裁,全球研讨、临床运营及生物统计暨亚太临床开发担任人汪来表示,“替雷利珠单抗”目前有15项注册临床实验,其中11项是III期临床实验,包括一项针对二线或三线非小细胞肺癌患者的3期临床研讨、一项针对一线肝细胞癌患者的3期临床研讨、一项针对二线食道鳞状细胞癌患者的3期临床研讨、一项针对一线胃癌患者的3期临床研讨、一项针对一线食道鳞状细胞癌患者的3期临床研讨等。

按弗若斯特沙利文的预算,2015年中国430万肿瘤发病患者中,有近300万属于十大PD1/PDL1应对肿瘤。据其预测,2030年全球PD1/PDL1药物市场规模可以到达789亿美元,其中中国可以到达131亿美元。
关于PD-1单抗厂家来说,疗效明显、顺应场景丰厚将是制胜的关键。目前,“帕博利珠单抗”与“纳武利尤单抗”在国际获批已有一年多,已双双播种两个顺应症,值得一提的是,“帕博利珠单抗”已行将迎来第三个顺应症:独自用于一切PD-L1表达阳性,无EGFR或ALK渐变的部分早期或转移性非小细胞肺癌一线医治。
2019年上半年业绩显示,默沙东全球销售支出225.75亿美元,中心产品之一的“帕博利珠单抗”营收到达49.03亿美元;2019年Q2期内,百时美施贵宝于营收62.7亿美元,“纳武利尤单抗”的销售额增长12%至18.2亿美元。
| 上一篇:重磅:突破传统细胞制备工艺 宾大研究团队一日生产出CAR-T细胞 | 下一篇:医保谈判引股市震荡 传君实、信达PD-1已进医保 |




