1类化药临床审批概略
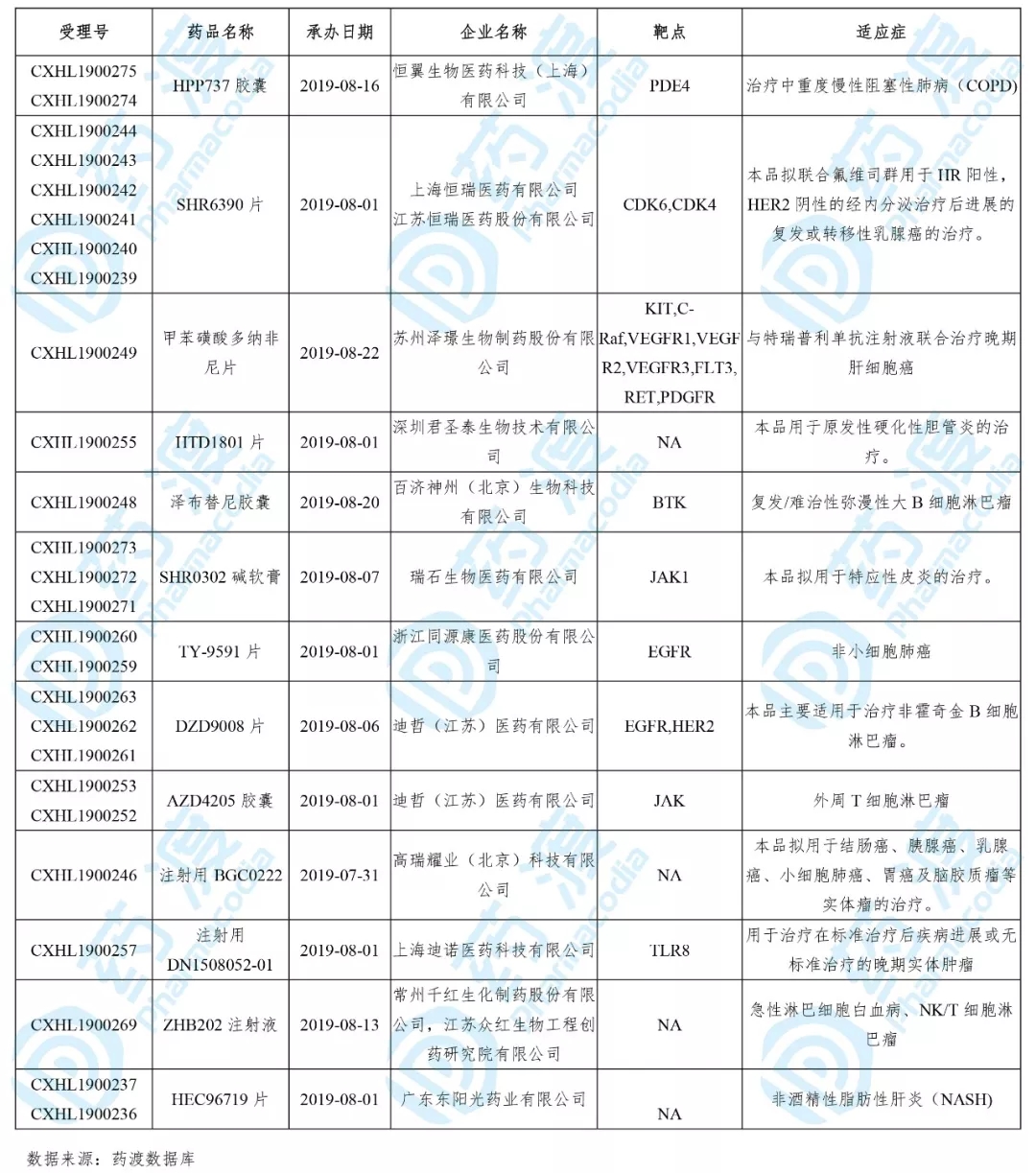
2019年10月,共有13个中国1类化药取得国度药品监视管理局的临床实验默示答应,详细信息如下表所示:
01、HPP737胶囊
HPP737由vTvTherapeutics研发。2019年8月16日HPP737的临床实验请求取得CDE承办,10月失掉临床实验默示答应用于医治中重度慢性阻塞性肺病在中国开端。
2018年3月,SHR6390结合来曲唑医治激素受体阳性、HER2阴性早期乳腺癌的Ib/II期临床研讨在中国开端。
2016年4月,SHR6390片在早期实体瘤患者中的耐受性及药代动力学 I期临床研讨在中国启动。
2016年4月,SHR6390片在早期黑色素瘤患者中的耐受性及药代动力学 I期临床研讨在中国启动。
2014年6月,由江苏恒瑞和上海恒瑞结合向CFDA提交临床实验请求,并于2015年10月取得化药1.1类临床批件。
03、甲苯磺酸多纳非尼片
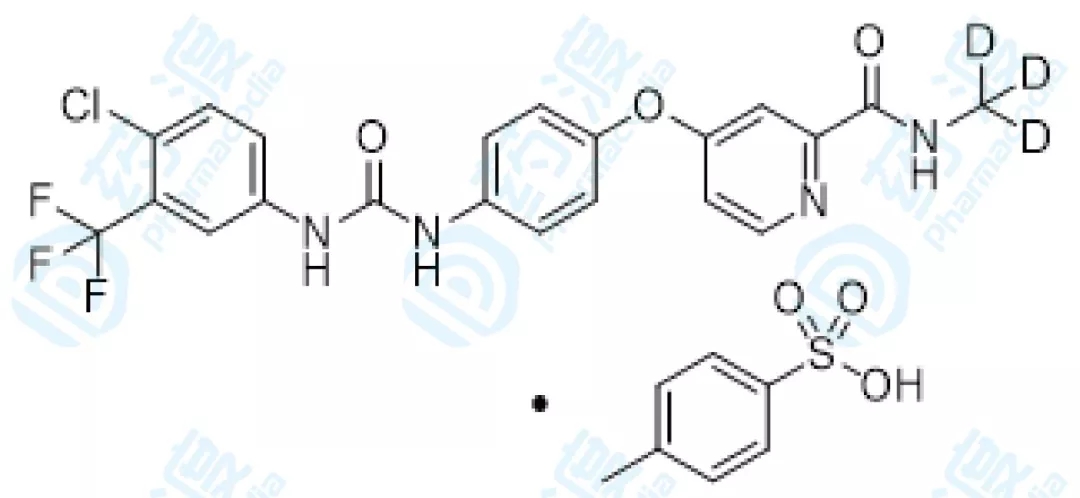
甲苯磺酸多纳非尼是泽璟生物研发的氘取代索拉非尼衍生物,是一款口服多激酶抑制剂,具有双重的抗肿瘤作用:经过抑制丝氨酸-苏氨酸激酶信号传导通路而直接抑制肿瘤细胞的增殖;经过抑制VEGFR和血小板衍生生长因子受体阻断肿瘤重生血管的构成,直接抑制肿瘤细胞的生长。
研发里程碑:
2019年8月22日甲苯磺酸多纳非尼片的临床实验请求取得CDE承办,10月失掉临床实验默示答应与特瑞普利单抗注射液结合医治早期肝细胞癌。
2018年3月,评价甲苯磺酸多纳非尼片医治部分早期/转移性RAIR-DTC患者的无效性和平安性的多中心、随机、双盲、抚慰剂对照的Ⅲ期临床实验在中国展开。
2016年12月,甲苯磺酸多纳非尼片医治早期结直肠癌的随机、双盲、抚慰剂对照、多中心Ⅲ期临床研讨在中国患者中开端,以评价多纳非尼的疗效及平安性。
2016年11月,甲苯磺酸多纳非尼片医治二线早期鼻咽癌患者的开放、单中心IB期临床研讨在中国启动。
2016年3月,甲苯磺酸多纳非尼片一线医治早期肝细胞癌患者的开放、随机、平行对照、多中心Ⅱ/Ⅲ期临床研讨启动。
2015年10月,苏州泽璟委托泰格医药展开甲苯磺酸多纳非尼片关于肝细胞癌的III期临床研讨。
2015年6月,甲苯磺酸多纳非尼片医治二线以上早期食管癌患者的开放、单中心IB/II期临床研讨启动。
2015年5月,甲苯磺酸多纳非尼片医治二线以上早期胃癌患者的随机、开放、平行对照、单中心I/II期临床研讨在中国启动。
2011年12月,由苏州泽璟生物制药无限公司向国度药品监视管理局提交的临床实验请求获CDE承办,且于2012年11月29日取得临床实验批件。
04、HTD1801片
HTD-1801由深圳君圣泰研发,处于临床二期,用于医治原发性硬化性胆管炎。HTD-1801处于医治高胆固醇血症的一/二期临床实验阶段。2018年9月,HTD-1801获FDA疾速通道审评资历,用于医治原发性硬化性胆管炎。这能够是FDA在该顺应症范畴授予的首个疾速通道审评资历。2019年8月1日HTD1801片的临床实验请求取得CDE承办且在2019年10月取得临床实验默示答应。
05、泽布替尼胶囊
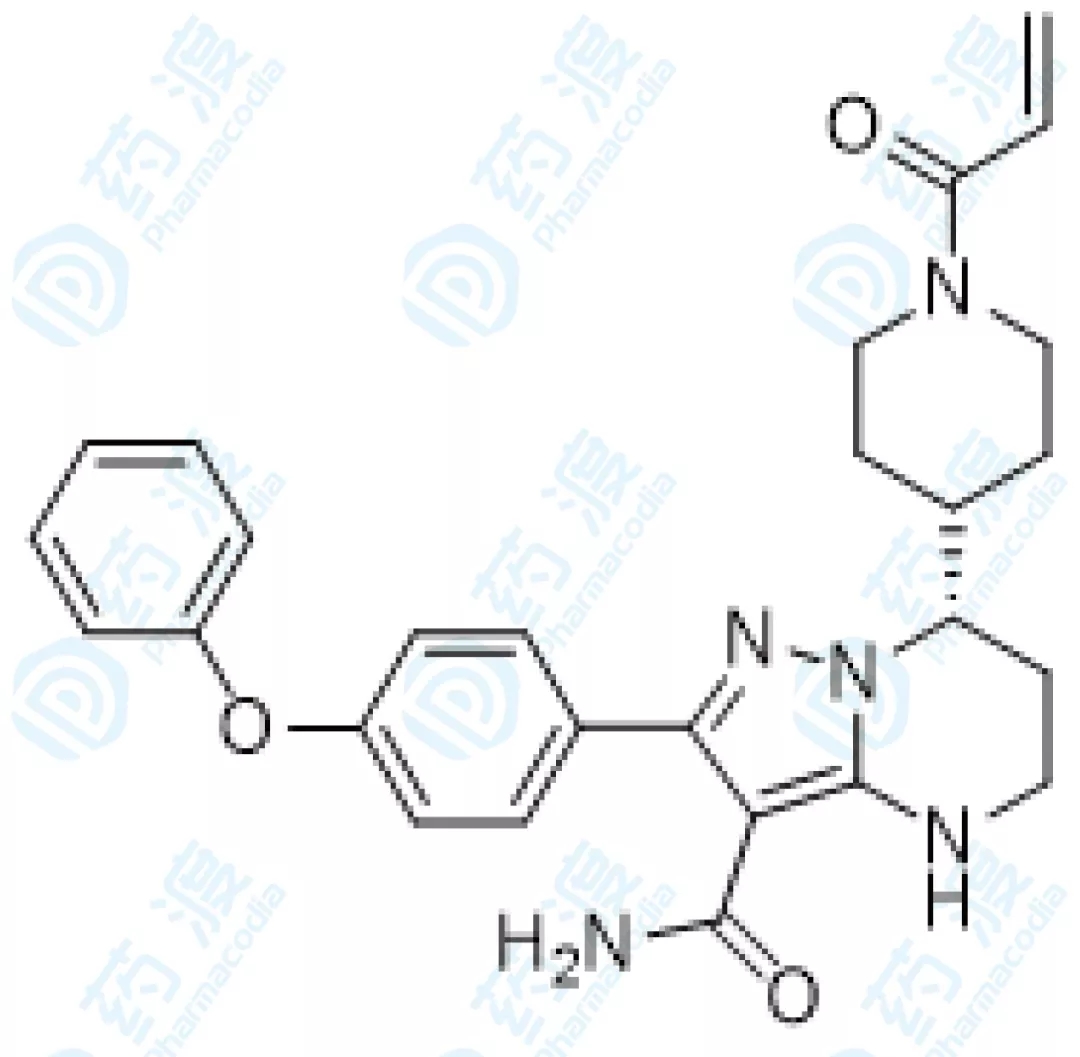
泽布替尼是一种强效、具有高选择性的小分子BTK抑制剂,可阻断相关信号传递,从而抑制恶性增殖B细胞的生长并杀死肿瘤细胞,由百济神州研发。
研发里程碑:
2019年8月20日该药的临床实验请求取得CDE承办,10月失掉药品审评中心的临床实验默示答应,用于医治复发/难治性洋溢性大B细胞淋巴瘤。
2019年8月22日,百济神州宣布美国FDA已受理泽布替尼用于医治复发/难治性套细胞淋巴瘤患者的新药上市请求并授予优先审评资历。
2019年1月15日,百济神州的BTK抑制剂泽布替尼获FDA授予的打破性疗法认定,用于医治先前至多承受过一种医治的成年套细胞淋巴瘤患者,成为首获美打破性疗法认定的中国外乡抗癌药。
2018年11月,BGB-3111用于复发性或难治性边缘区淋巴瘤的II期开放性研讨拟在中国停止。
2019年2月,医治R/RMZL的全球Ⅱ期临床研讨启动。
2018年10月,泽布替尼胶囊用于复发/难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤患者潜在疗法的NDA获NMPA受理。
2018年8月,BGB-3111用于医治复发/难治性套细胞淋巴瘤患者的NDA获CFDA受理。
2018年7月,BGB-3111取得FDA的疾速通道资历用于医治华氏巨球蛋白血症患者。
2017年2月,一项对复发/难治性套细胞淋巴瘤患者的临床II期实验完成第一例受试者入组。
2017年1月,BGB-3111对原发性巨球蛋白血症的全球三期临床实验启动。
2016年,BGB-3111取得FDA的3项孤儿药资历认定,辨别用于医治套细胞淋巴瘤、华氏巨球蛋白血症和慢性淋巴细胞白血病。
06、SHR0302碱软膏
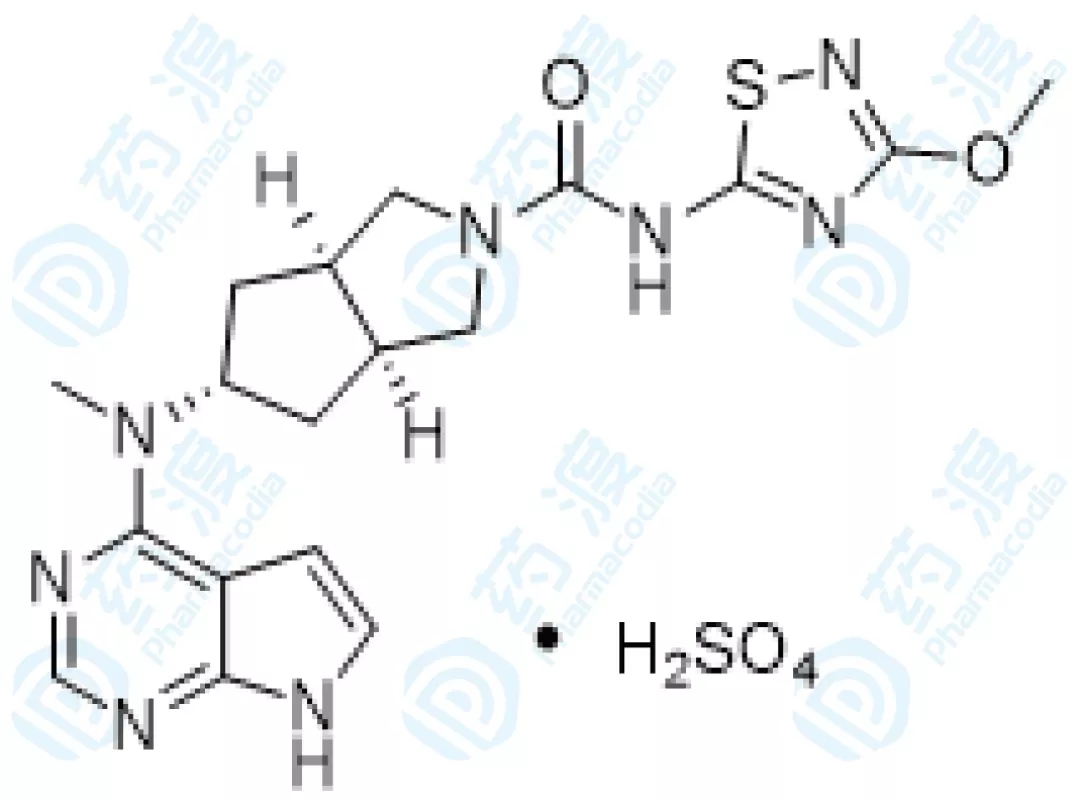
SHR-0302是江苏恒瑞研发的JAK1抑制剂,用于医治类风湿性关节炎、溃疡性结肠炎、特应性皮炎和克罗恩氏病。江苏恒瑞将外用皮肤科范畴研讨的局部权益授予Arcutis,将除类风湿性关节炎及外用皮肤科范畴的全球权益授予瑞石生物。
研发里程碑:
2019年8月7日该药的临床实验请求取得CDE承办,10月瑞石生物收到国度药品监视管理局核准签发的SHR0302碱软膏《临床实验告诉书》,拟适用于特应性皮炎的医治。
2019年5月,获NMPA的II期临床批件,用于医治中重度特应性皮炎。
2019年4月12日,瑞石生物医药无限公司已收到波兰药品、医疗器械和生物产品注册局核准签发的同意信,并将于近期展开临床实验。
2019年1月,瑞石生物医药无限公司向国度药品监视管理局提交临床实验请求。
2019年4月,取得临床实验默示答应。
2018年12月20日,瑞石生物医药无限公司向波兰药品、医疗器械和生物产品注册局递交的临床实验请求获受理,针对溃疡性结肠炎和克罗恩病。
2018年12月,SHR-0302的克罗恩病II 期临床研讨请求获美国FDA同意。
2018年10月,SHR-0302在美国的II 期临床研讨请求获FDA同意,拟用于溃疡性结肠炎的医治。
2018年8月,在中国再次提交临床请求。
2017年9月,在中至重度活动性类风湿关节炎患者中评价SHR-0302片的疗效及平安性的多中心、随机、双盲、抚慰剂对照II期研讨在中国开端。
2015年5月,SHR-0302安康受试者单次给药人体耐受性及药代/药效动力学的单中心、随机、双盲、抚慰剂对照的临床I期研讨在中国启动,并于2018年1月完成。
2013年7月,由江苏恒瑞医药股份无限公司和上海恒瑞医药无限公司结合初次向CFDA提交了临床实验请求,并于2015年2月取得临床实验批件。
07、TY-9591片
TY-9591是由浙江同源康医药股份无限公司自主研发的第三代表皮生长因子受体抑制剂,用于医治非小细胞肺癌。2019年8月1日,国度药品监视管理局受理本品的临床实验请求,10月份,取得CDE临床实验默示答应。
目前靶向EGFR的同靶点同顺应症的中国1类药物如下表所示:
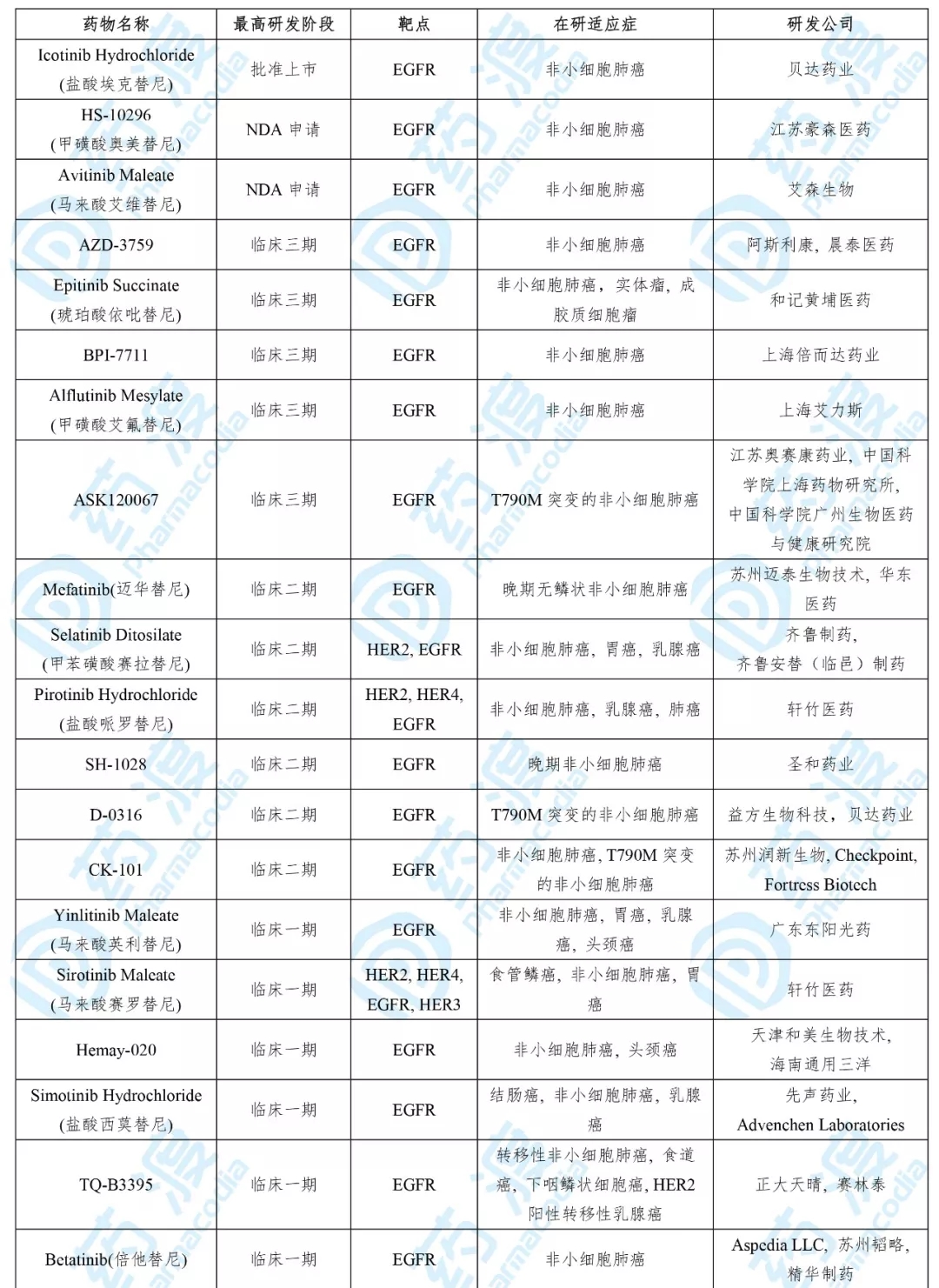
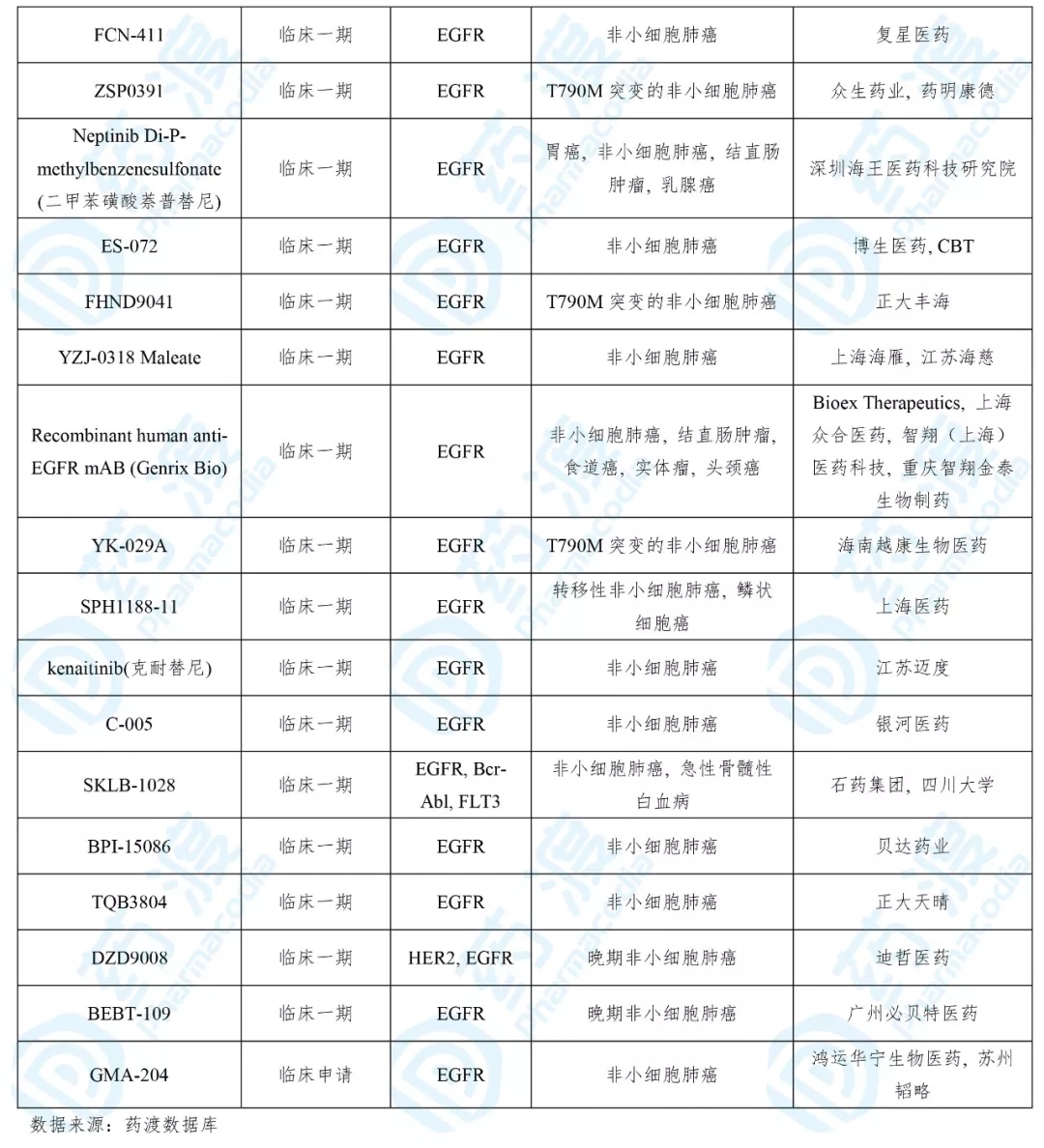
08、DZD9008片
DZD9008由迪哲医药无限公司研发,2019年4月国度药品监视管理局受理本品的临床实验请求,7月被默示答应临床实验,拟用于医治EGFR或HER2渐变的早期非小细胞肺癌;2019年8月该药的临床实验请求再次失掉受理,于10月被默示答应临床实验用于医治非霍奇金B细胞淋巴瘤。
目前用于医治非霍奇金B细胞淋巴瘤的中国1类药物如下表所示:
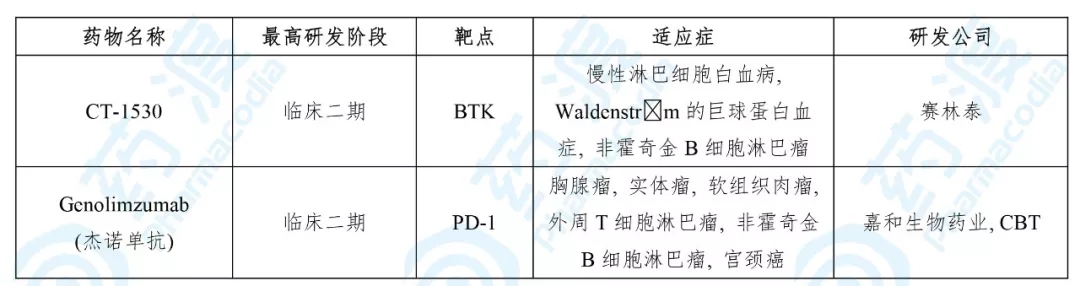
数据来源:药渡数据库
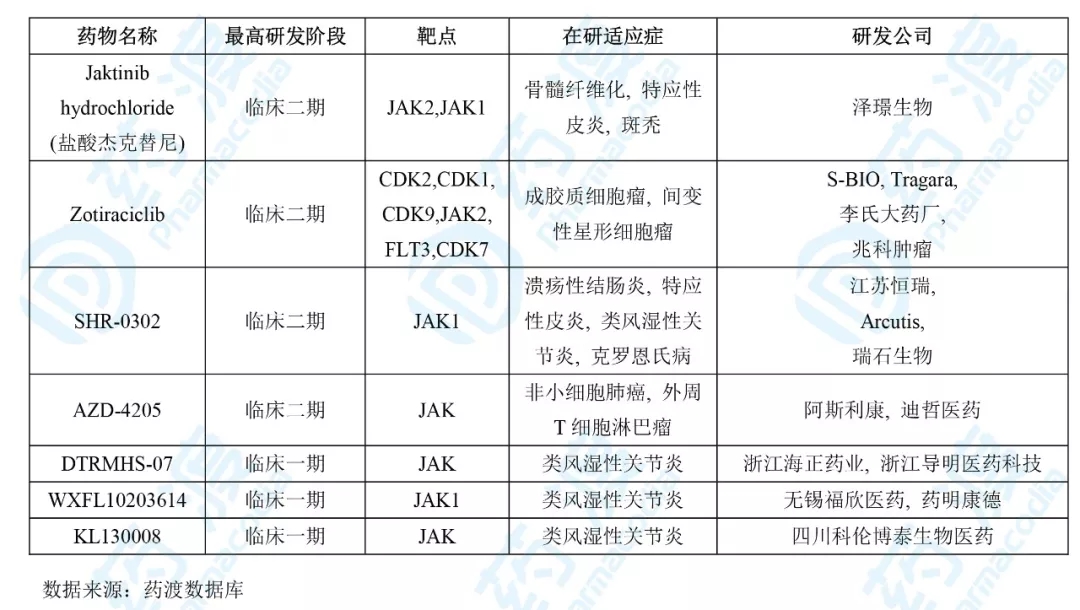
09、AZD4205胶囊
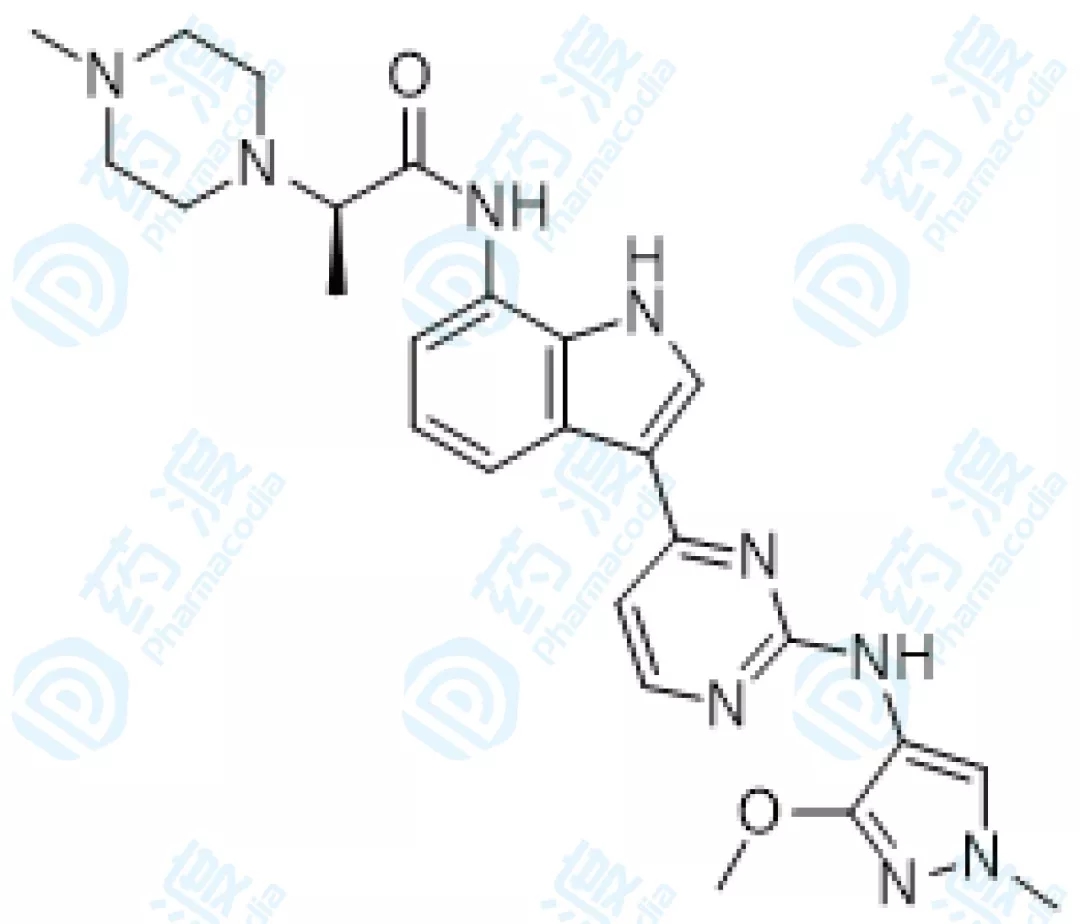
AZD-4205是由阿斯利康和迪哲医药无限公司结合开发的一种JAK1激酶抑制剂,目前阿斯利康正在停止用于医治非小细胞肺癌和外周T细胞淋巴瘤的临床一/二期,以及医治本身免疫性疾病和炎症性肠病的临床一期实验。
2018年12月,国度药品监视管理局受理迪哲医药无限公司提交的临床实验请求。2019年3月,取得临床默示答应,拟用于医治本身免疫性疾病。2019年8月该药的临床实验请求再次失掉受理,2019年10月被默示答应用于医治外周T细胞淋巴瘤。
目前靶向JAK的同靶点的中国1类药物如下表所示:
10、注射用BGC0222
BGC0222由高瑞耀业科技无限公司研发,于2019年7月向国度药品监视管理局递交了临床实验请求。2019年10月被默示答应拟用于结肠癌、胰腺癌、乳腺癌、小细胞肺癌、胃癌及脑胶质瘤等实体瘤的医治。
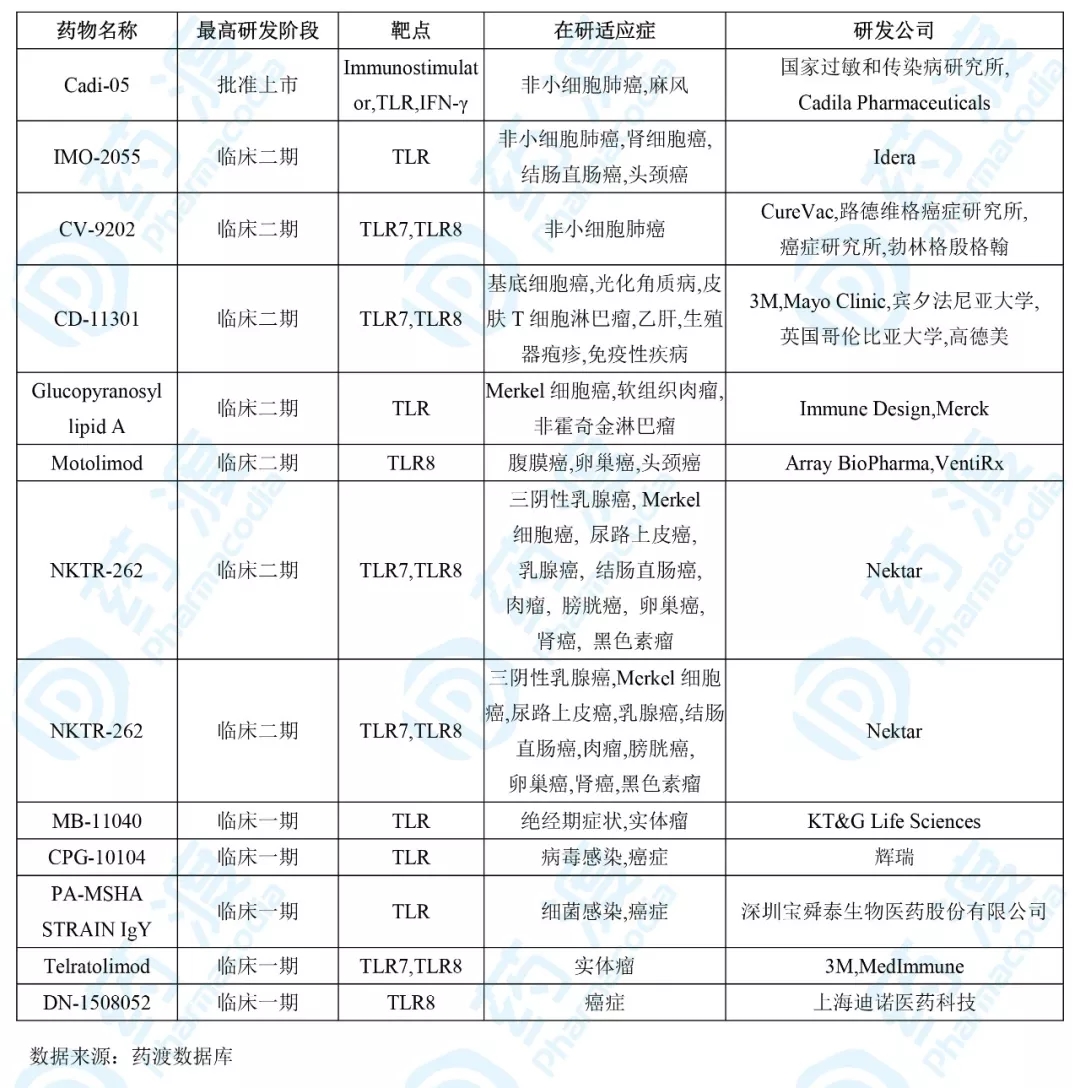
11、注射用DN1508052-01
DN-1508052由上海迪诺医药科技研发,是一种高效的小分子Toll样受体8冲动剂,用于医治癌症,目前处于临床一期。注射用DN1508052-01于2019年8月1日取得CDE承办,10月获批临床,用于医治在规范医治后疾病停顿或无规范医治的早期实体肿瘤。
目前靶向TLR的同靶点同顺应症的中国1类药物如下表所示:
12、ZHB202注射液
ZHB-202由千红制药研发,用于急性淋巴细胞白血病、NK/T细胞淋巴瘤的医治。2019年8月,国度药品监视管理局受理本品的临床实验请求。2019年10月,取得临床实验默示答应。
13、HEC96719片
HEC-96719由广东东阳光药业股份无限公司研发,用于医治非酒精性脂肪性肝炎。2019年8月,国度药品监视管理局受理本品的临床实验请求,2019年10月,取得临床实验默示答应。
1类生物药临床审批概略
2019年10月,共有11个中国1类医治用生物制品取得国度药品监视管理局的临床实验默示答应,详细信息如下表所示:
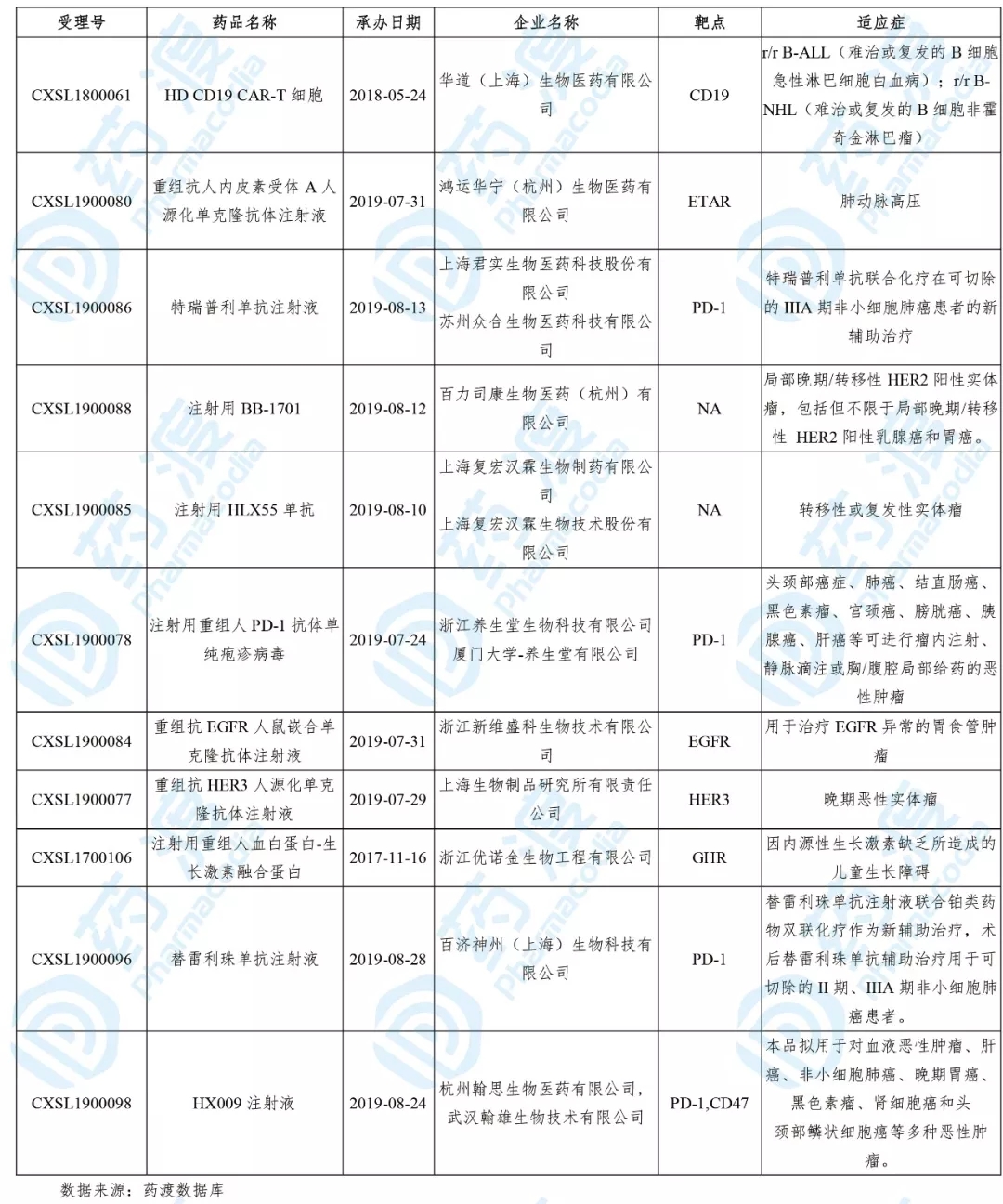
01、HD CD19 CAR-T细胞
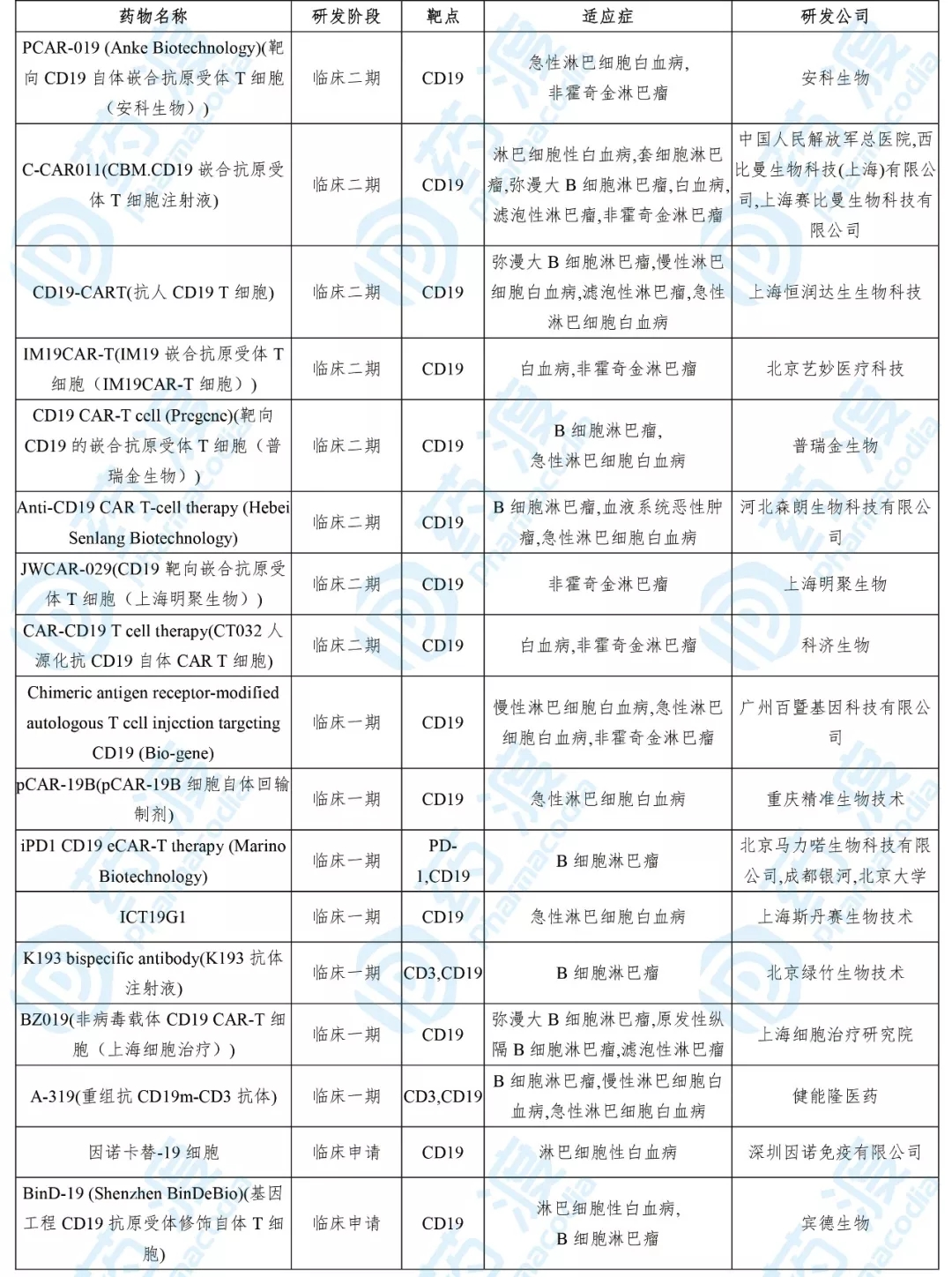
华道生物开发的HD CD19 CAR-T细胞次要用于医治急性淋巴细胞白血病和非霍奇金淋巴瘤。该产品向国度药品监视管理局药品审评中心递交了新药临床实验请求,并于2018年5月取得受理。2019年8月该药的临床实验请求失掉受理,10月被默示答应临床实验,用于医治r/rB-ALL以及r/r B-NHL。
目前靶向CD19的中国1类药物如下表所示:
数据来源:药渡数据库
02、重组抗人内皮素受体A人源化单克隆抗体注射液
鸿运华宁生物医药开发的重组抗人内皮素受体A人源化单克隆抗体于2019年7月向国度药品监视管理局递交了临床实验请求。2019年10月,组抗人内皮素受体A人源化单克隆抗体注射液被默示答应临床实验,用于医治肺动脉高压。
03、特瑞普利单抗注射液
特瑞普利单抗开发的一种人源化单克隆抗体,靶向于顺序性死亡受体1。2018年12月17日,特瑞普利单抗注射液的上市请求取得NMPA有条件同意,用于医治既往承受全身零碎医治失败后的不可切除或转移性黑色素瘤患者,商品名为拓益®,成为首个在中国上市的自主研发的PD-1单抗。
研发里程碑:
2019年8月,该药取得CDE承办,2019年10月,被默示答应用于IIIA期非小细胞肺癌患者。
2019年4月,向NMPA提交了IND请求,与索凡替尼胶囊结合用于实体瘤患者,2019年6月,取得临床实验默示答应。
2019年2月,JS001和泽璟生物CM4307结合展开医治早期肝细胞癌的临床研讨。
2018年12月,JS001或抚慰剂结合注射用紫杉醇医治首诊IV期或复发转移TNBC的III期、多中心、随机、双盲、抚慰剂对照研讨开端在中国招募患者。
2018年12月17日,特瑞普利单抗注射液的上市请求获NMPA同意,用于医治既往承受全身零碎医治失败后的不可切除或转移性黑色素瘤患者,商品名为拓益®。此次同意是基于已完成的中国早期黑色素瘤II期研讨无效性数据和7项临床研讨的平安性数据。本品的临床实验后果显示,医治既往承受全身零碎医治失败的不可切除或转移性黑色素瘤患者的客观缓解率达17.3%,疾病控制率达57.5%,1年生活率达69.3%。
2018年7月,JS001与CM082结合拟用于既往未经医治的部分停顿或转移性黏膜黑色素瘤的临床实验请求已获国度药监局受理。
2018年3月,JS001黑色素瘤顺应症的消费请求,取得CFDA受理。
2018年1月,JS001获FDA同意停止药物临床实验2,且于2018年3月,完成首例患者给药。
2017年4月,一项调查JS001注射液在规范医治失败后的早期神经内分泌肿瘤患者中的平安性和无效性的Ib期临床研讨在中国开端,估计将于2019年6月完成。
2016年12月,一项评价JS001医治早期胃腺癌、食管鳞癌、鼻咽癌和头颈部鳞癌的多中心、开放Ib/II期临床研讨在中国开端,估计将于2019年10月完成。
2016年3月,JS001对实体瘤的Ia期临床研讨开端招募患者。
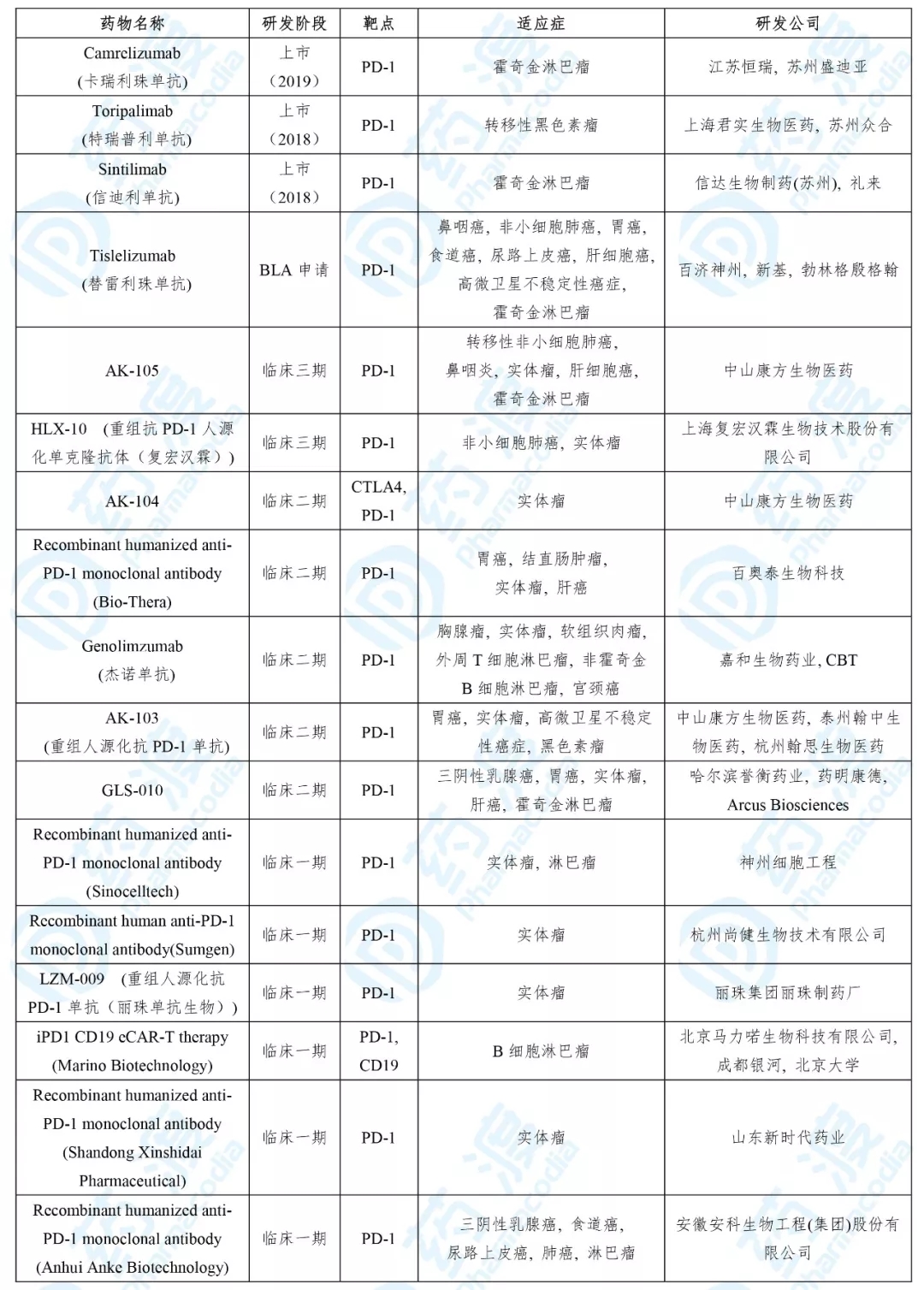
目前靶向PD-1的同靶点的中国1类药物如下表所示:
数据来源:药渡数据库
04、注射用BB-1701
BB-1701是一种抗体偶联药物,目前处于临床一期实验阶段,用于医治HER2阳性实体瘤。
研发里程碑:
2019年10月,注射用BB-1701被临床默示答应用于医治部分早期/转移性HER2阳性实体瘤,包括但不限于部分早期/转移性HER2阳性乳腺癌和胃癌。
2019年8月,该药在中国的IND请求取得国度药品监视管理局承办,为医治用生物制品一类。
2019年7月,该药在美国的IND请求取得FDA同意。
05、注射用HLX55单抗
HLX55是一种靶向酪氨酸蛋白激酶的抗体,用于医治胃癌、肝癌、肺癌、转移性或复发性实体瘤等。该单抗药物最后由美国Kolltan公司开发,之后上海复宏汉霖取得了相关研发受权。目前,该药的IND请求曾经取得国度药品监视管理局承办,为医治用生物制品一类。2019年10月,注射用HLX55单抗失掉临床默示答应。
06、注射用重组人PD-1抗体单纯疱疹病毒
养生堂无限公司和厦门大学协作开发的重组人PD-1抗体单纯疱疹病毒于2019年7月向国度药品监视管理局递交了临床实验请求。于2019年10月被默示答应临床实验,用于头颈部癌症、肺癌、结直肠癌、黑色素瘤、宫颈癌、膀胱癌、胰腺癌、肝癌等可停止瘤内注射、静脉滴注或胸/腹腔部分给药的恶性肿瘤。
07、重组抗EGFR人鼠嵌合单克隆抗体注射液
浙江新维盛科生物技术无限公司开发的重组抗EGFR人鼠嵌合单克隆抗体已于2019年7月向国度药品监视管理局递交了临床实验请求。2019年10月被默示答应临床实验,用于医治EGFR异常的胃食管肿瘤。
08、重组抗HER3人源化单克隆抗体注射液
上海生物制品研讨所开发的一种靶向Her3的人源化单克隆抗体,将用于医治早期恶性实体瘤。2019年7月,该药的IND请求取得国度药品监视管理局承办,为医治用生物制品1类,2019年10月取得默示答应。
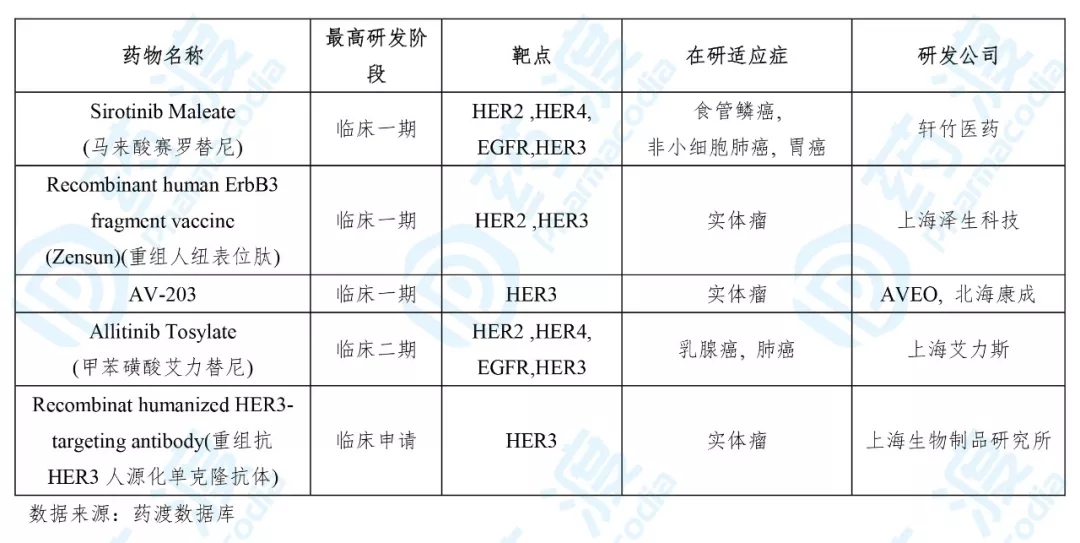
目前靶向HER3的同靶点的中国1类药物如下表所示:
09、注射用重组人血白蛋白-生长激素交融蛋白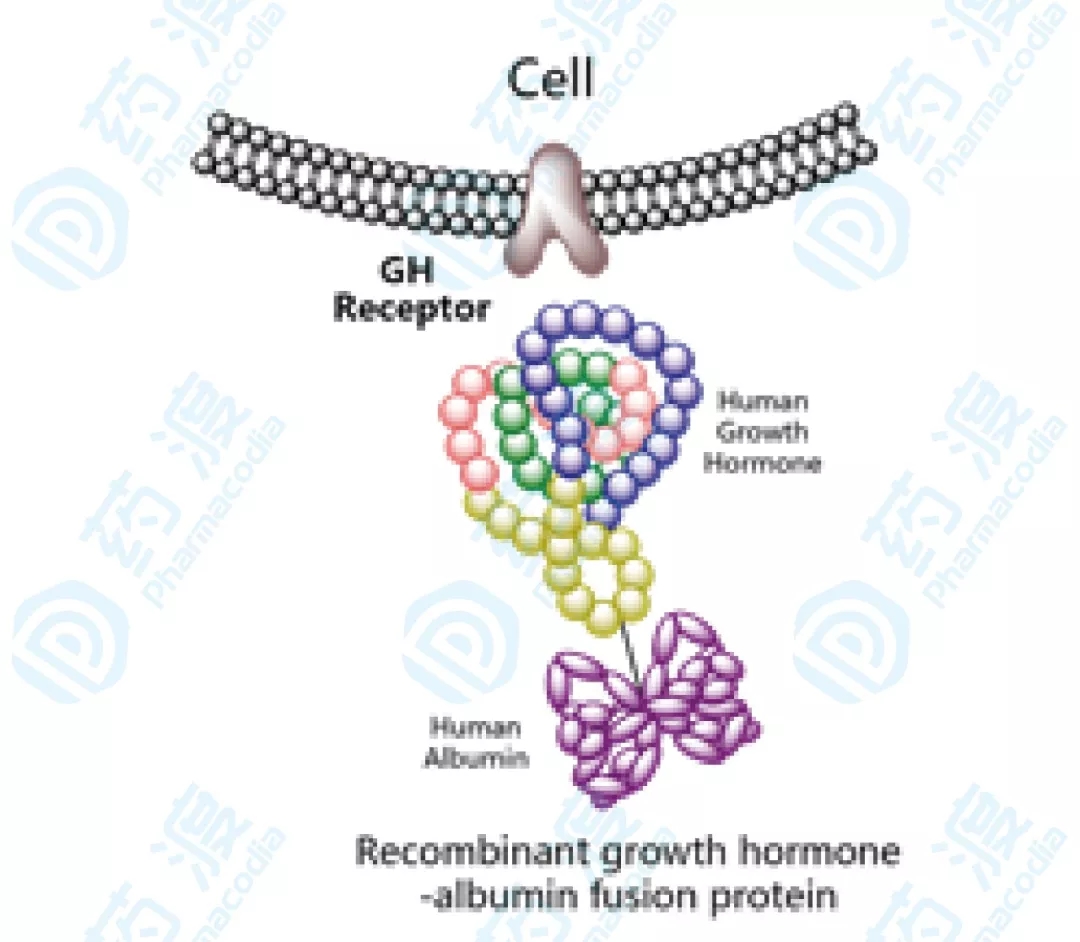
优诺金生物工程开发的注射用重组人血白蛋白-生长激素交融蛋白已于2017年11月向国度药品监视管理局药品审评中心递交了新药临床实验请求。于2019年10月取得默示答应,用于医治因内源性生长激素缺乏所形成的儿童生长妨碍。
目前靶向GHR的同靶点的中国1类药物如下表所示:
10、替雷利珠单抗注射液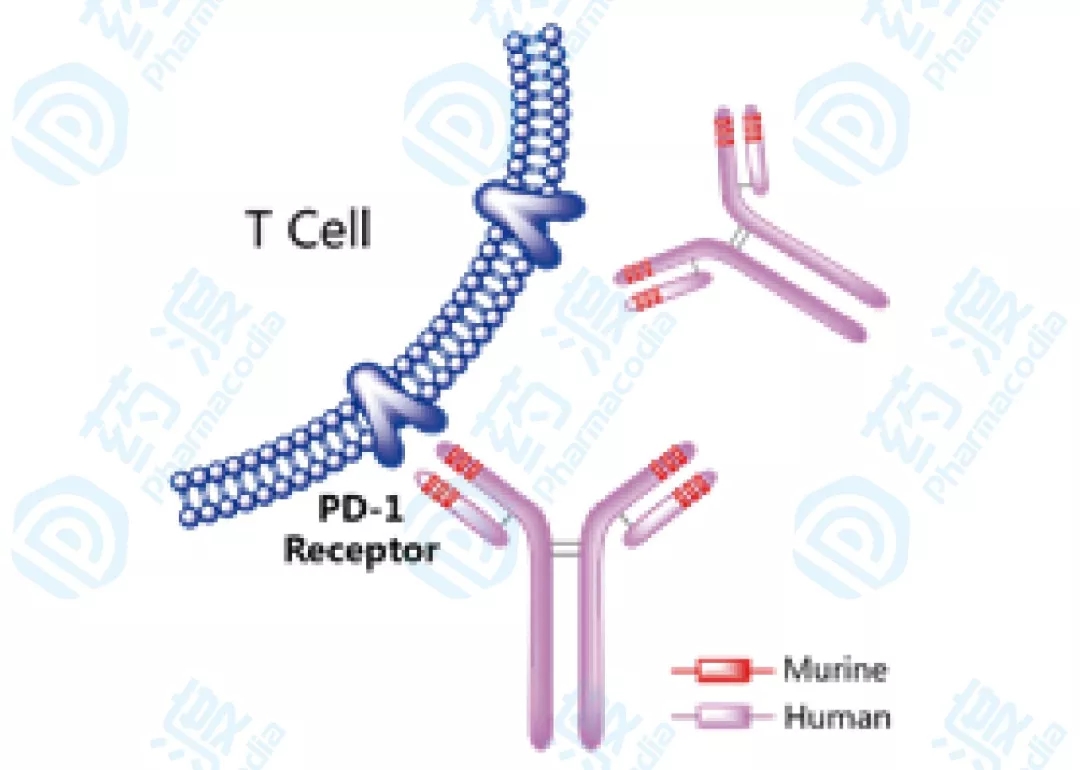
Tislelizumab是由百济神州研发的一种靶向于顺序性死亡受体1的IgG4型单克隆抗体,能与T细胞外表障碍免疫激活的重要受体PD-1结合,抑制PD-1,并肃清癌细胞激活免疫零碎的障碍要素,从而恢复T细胞的肿瘤杀伤才能。
Tislelizumab于2018年由勃林格殷格翰和百济神州向中国国度药品监视管理局提交了上市请求。此外还在中国展开医治非小细胞肺癌、肝细胞癌和食管鳞状细胞癌的临床三期实验,以及医治霍奇金淋巴瘤、尿路上皮癌、胃癌或胃食管结合部癌以及高微卫星不波动性实体瘤的临床二期研讨,并在全球展开医治肝细胞癌的临床三期研讨,同时也在新西兰、澳大利亚、中国、韩国、台湾和美国停止医治实体瘤的临床一期研讨。2019年6月,国度药品监视管理局承办了百济神州提交的用于医治先前承受过医治或转移性尿路上皮癌的上市请求。2019年10月,该药取得国度药品监视管理局的临床默示答应。
11、HX009注射液
HX-009是一种靶向PD-1和CD47的双特性抗体。经过阻断CD47,发扬巨噬细胞的靶向杀伤作用。该药由杭州翰思生物医药无限公司、武汉翰雄生物技术无限公司开发。2019年8月,该药的IND请求取得国度药品监视管理局承办,为医治用生物制品一类。2019年10月,该药取得临床默示答应,拟用于对血液恶性肿瘤、肝癌、非小细胞肺癌、早期胃癌、黑色素瘤、肾细胞癌和头颈部鳞状细胞癌等多种恶性肿瘤。
中国1类新药NDA请求概略
2019年10月,国度药品监视管理局药审中心共承办了1个中国1类新药的NDA请求,详细信息如下表所示:
01、氟唑帕利胶囊
氟唑帕利是恒瑞医药和豪森医药研发的PARP1/2抑制剂。目前,该药的上市请求取得CDE承办,顺应症为复发性卵巢癌。
研发里程碑:
2019年10月,该药的NDA请求取得国度药品监视管理局承办。
2019年4月,SHR3680结合氟唑帕利医治去势抵抗性前列腺癌的II期临床研讨在中国开端招募患者,由恒瑞医药申办。
2019年2月,氟唑帕利胶囊比照抚慰剂用于复发性卵巢癌维持医治的随机、双盲、对照、多中心Ⅲ期临床研讨已在中国开端,由恒瑞医药申办。
2019年1月,由恒瑞提交的中国1类临床请求获CDE受理,并于2019年3月取得临床默示答应。
2018年7月,由恒瑞医药提交的临床补充请求获CDE受理,后于2018年9月取得临床实验批件。
2018年4月,在BRCA1/2渐变的复发性卵巢癌患者中停止的单臂、多中心Ⅰb期临床研讨在中国开端,后同一方案对卵巢癌临床II期实验显示已在中国开端,由豪森医药申办。
2017年3月,氟唑帕利结合阿帕替尼医治卵巢癌或三阴性乳腺癌的I期临床研讨在中国开端,由豪森医药申办。
2017年2月,氟唑帕利结合阿帕替尼和紫杉醇医治胃癌的 I期临床研讨在中国开端,由豪森医药申办。
2015年4月,氟唑帕利在早期实体瘤患者中的耐受性及药代动力学I期临床研讨在中国开端,并于2018年3月完成。
2012年12月,由豪森医药提交的IND请求取得CDE受理,并于2013年9月取得临床批件。
| 上一篇:地方医保增补 新消息传出 | 下一篇:一批重磅药首家过评:天士力、恒瑞、石药…(附名单) |




